Version [69721]
Dies ist eine alte Version von TutoriumChemieStoechiometrie erstellt von Jorina Lossau am 2016-07-09 17:38:15.
Tutorium Chemie
| File | Last modified | Size |
|---|---|---|
| ChemieStoechiometrie.pdf | 2023-10-06 18:37 | 731Kb |
| ChemieStoechiometrie1.jpg | 2023-10-06 18:37 | 205Kb |
| ChemieStoechiometrie2.jpg | 2023-10-06 18:37 | 34Kb |
| ChemieStoechiometrie3.jpg | 2023-10-06 18:37 | 48Kb |
| ChemieStoechiometrie4.jpg | 2023-10-06 18:37 | 48Kb |
| ChemieStoechiometrie5.jpg | 2023-10-06 18:37 | 43Kb |
| ChemieStoechiometrie6.jpg | 2023-10-06 18:37 | 59Kb |
| ChemieStoechiometrie7.jpg | 2023-10-06 18:37 | 43Kb |
| Grafik1.jpg | 2023-10-06 18:37 | 206Kb |
| Grafik2.jpg | 2023-10-06 18:37 | 26Kb |
| Grafik3.jpg | 2023-10-06 18:37 | 28Kb |
| Grafik4.jpg | 2023-10-06 18:37 | 29Kb |
| Grafik5.jpg | 2023-10-06 18:37 | 19Kb |
Chemisches Gleichgewicht - Grundlagen stöchiometrisches Rechnen
Chemisches Gleichgewicht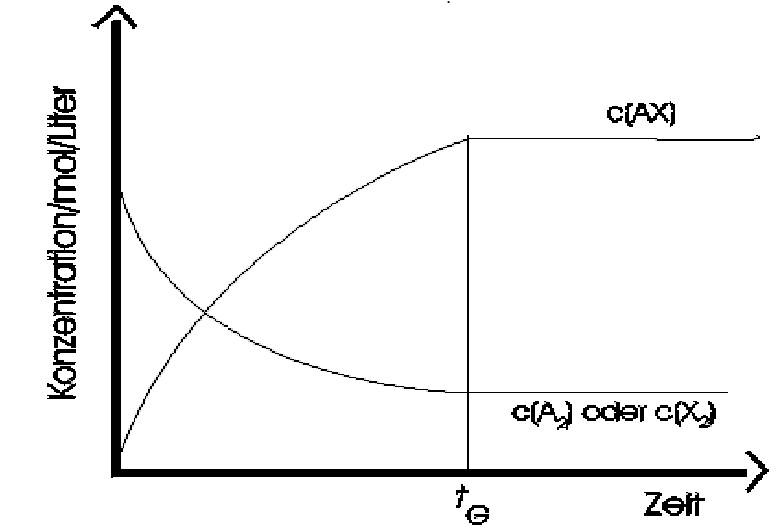 Katalysator Wirkprinzip (graphisch): 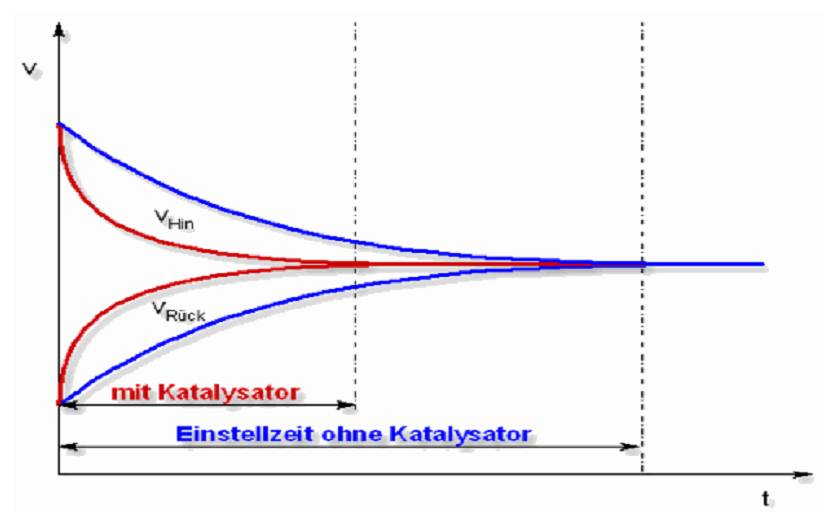 Katalysator Katalysator bei exothermen Reaktionen: 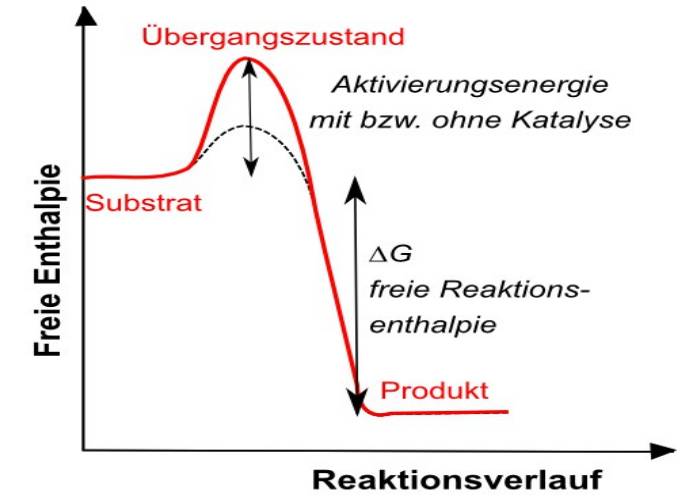 Katalysator Katalysator bei endothermen Reaktionen: 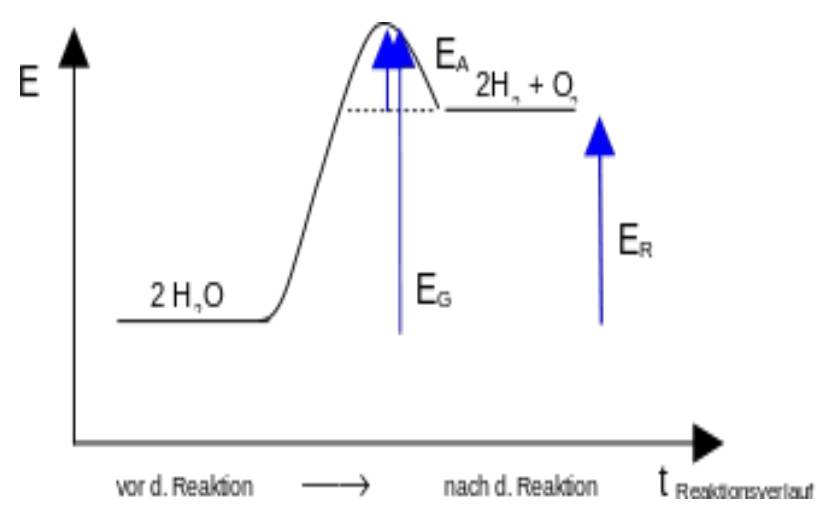 Stöchiometrisches Rechnen Konstanten/Grundgleichungen:
Formeln: c = n/V
Χ = mi/V(l)
p V = n R T
|
| PDF Dokument Stöchiometrie |
Diese Seite wurde noch nicht kommentiert.





