Elektrochemie 1
Grundlagen, wichtige elektrochemische Bauteile
| Grundbegriffe Elektrochemische Reaktionen sind Redoxreaktionen, d.h Reaktionen mit Elektronenübergang. Sie können freiwillig ablaufen (galvanische Zelle) oder durch anlegen einer Spannung erzwungen werden (elektrolytische Zelle). Oxidation: Ist die Teilreaktion bei der Elektronen abgegeben werden. Reduktion: Ist die Teilreaktion bei der Elektronen aufgenommen werden. Anode: Elektrode, an der die Oxidation stattfindet Kathode: Elektrode, an der die Reduktion stattfindet → allgemeingültig, unabhängig von der Art der elektrochemischen Zelle Primärelemente:
Tertiärelement (Brennstoffzelle):
Galvanische Zelle:
Elektrolytische Zelle:
|
| Korrosion von Eisen an feuchter Luft - mehrstufige Reaktion aufgrund der Modifikationen des Eisens-Ions (zwei- und dreiwertig) Oxidation 1: Fe-> Fe^(2+) + 2e^- Anoede(-) RM1 OM1 Reduktion 1: O2 + 4e^- --> 2O^(2-) Kathode(+) OM2 RM2 Folgereaktionen: 2O^(2-) + H2O -->4OH^- Gesamtreaktion: 2Fe + O2 + 2H2O -> 2Fe^(2+) + 4OH^- Ausfällreaktion: 2Fe^(2+) + 4OH -> 2Fe(OH)2 Oxidation 2: Fe^(2+) -> Fe^(3+) + e^- Anode(-) RM1 OM1 Reduktion 2: O2 + 2H2O + 4e^- ->4OH^- Kathode (+) OM2 RM2 Gesamtreaktion: 4Fe^(2+) + O2 + 2H2O -> 4Fe^(3+) + 4OH^- Folgereaktion: 4Fe^(3+) + 12OH^- -> 4Fe(OH)3 Weitere Reaktion bei ausreichender Feuchtigkeit: 2Fe(OH)3 -> 2FeO(OH) + 2H2O -> Fe2O3 + 3H2O |
Zink-Kohle-Batterie (Lechlanche Element)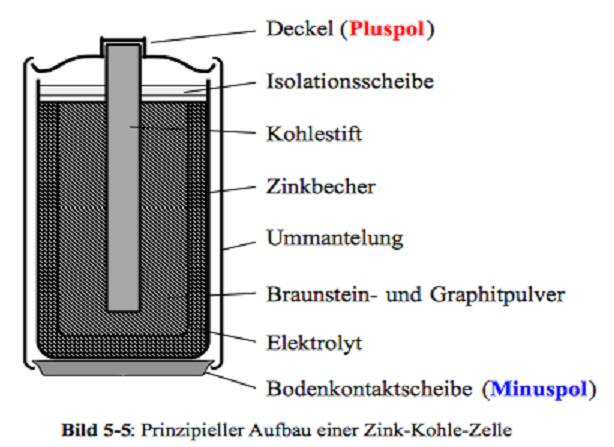 Oxidation: Zn -> Zn2 + 2e^- Anode (-) RM1 OM1 Reduktion: Mn + 4 + e^- -> Mn+3 Kathode (+) OM2 RM2 2MnO2 + 2e^- + H2O -> 2MnOOH + 2OH^- Folgereaktion: Zn2^(+) + 2OH- -> Zn(OH)2 -> ZnO + H20 Alkalinezelle 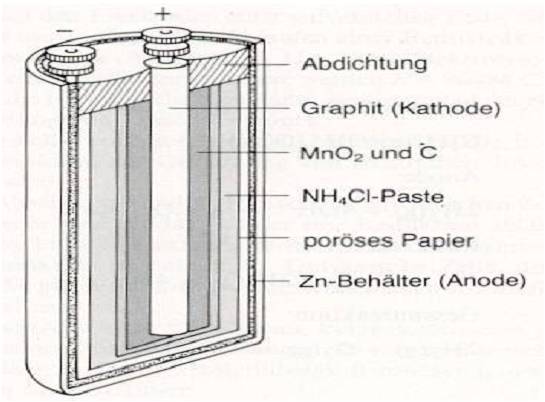 Reaktionen siehe Lechlanche-Element Zink-Luft-Batterie 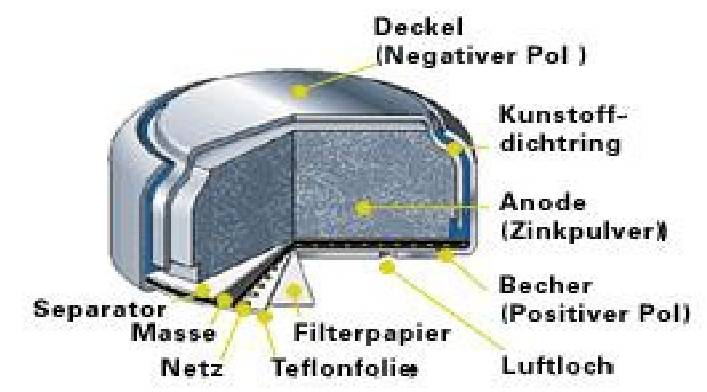 Oxidation: 2Zn -> 2ZN^(2+) + 4e^- Anode(-) RM1 OM1 Reduktion: O2 + 4e^- -> 2O^(2-) Kathode(+) OM2 RM2 Folgereaktion: 2O^(2-) + 2H2O -> 4OH Gesamtreaktion: 2Zn + O2 + 2H2O -> 2Zn(OH)2 oder ZnO + H2O Wasserbrennstoffzelle 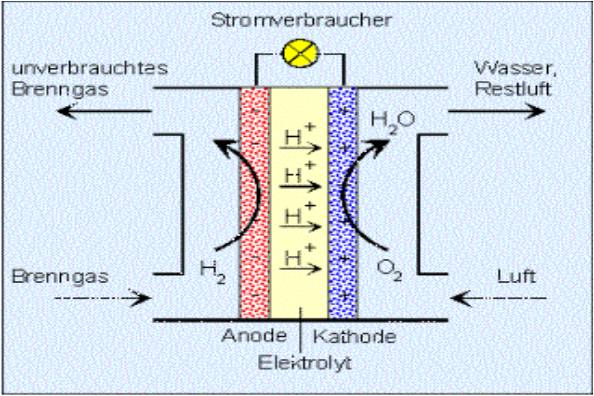 Oxidation: 2H2 -> 4H^(+) + 4e^(-) Anode(-) RM1 OM1 Reduktion: O2 + 4e^(-) -> 2O^(2-) Kathode(+) OM2 RM2 Gesamtreaktion: 2H2 + O2 -> 2H2O Bleiakkumulator (Entladevorgang) 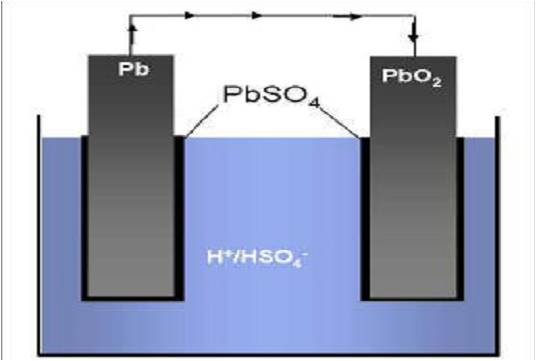 Oxidation: Pb -> Pb^(2+) + 2e^(-) Anode(-) RM1 OM2 Reduktion: (Pb+2e^(-) -> Pb) Kathode(+) PbO2 + 2e^(-) + 4H -> Pb^(2+) + H2O OM2 RM2 Gesamtreaktion: Pb + PbO2 + 4H^(+) + 2SO4^(2-) -> 2Pb^(2+)2H2O + 2SO4^(2-) Pb + PbO2 + H2SO4 -> 2PbSO4 + H2O Aluminiumschmelzflusselektrolyse (Elektrolytische Zelle) 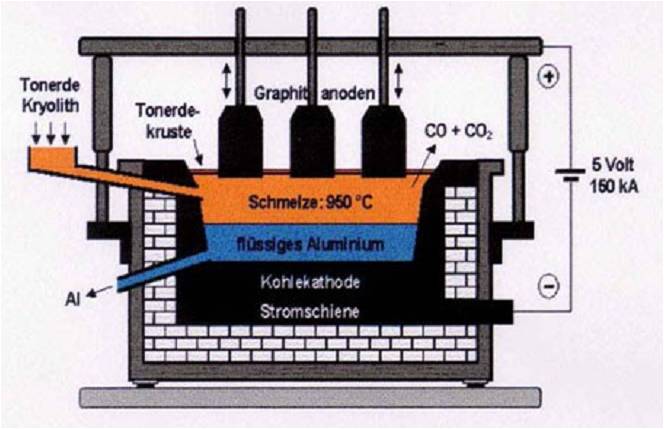 Ausgangsstoff: Al2O3 ( aus Bauxit durch Bayer-Verfahren gewonnen) Oxidation: C + 2O^(2-) -> CO2 + 4e^(-) Anode(+) RM1 OM1 Reduktion: Al^(3+) + 3e^(-) -> Al Kathode(-) OM2 RM2 Gesamtreaktion: 3C + 6O^(2-) + 4Al^(3+) -> 3CO2 + 4Al 3C + 2Al2O3 -> 3CO2 + 4Al |
| PDF Dokument Elektrochemie |
Diese Seite wurde noch nicht kommentiert.





